পরমাণুর অভ্যন্তরে ইলেকট্রনের অবস্থান এবং পারমাণবিক বর্ণালীর উৎস
২০২২ সালের এইচএসসি ও আলিম পরীক্ষায় অংশগ্রহণকারী শিক্ষার্থী বন্ধুরা তোমাদের জন্য এইচএসসি, আলিম শ্রেণির ৬ষ্ঠ সপ্তাহের অ্যাসাইনমেন্ট রসায়ন ১ম পত্রের বাছাইকৃত নমুনা উত্তর- (পরমাণুর অভ্যন্তরে ইলেকট্রনের অবস্থান এবং পারমাণবিক বর্ণালীর উৎস) প্রস্তুত করা হয়েছে। এইচএসসি ও আলিম ৬ষ্ঠ সপ্তাহের অ্যাসাইনমেন্ট রসায়ন ১ম পত্রের নির্ধারিত কাজে সর্বোচ্চ নম্বর পাওয়ার জন্য এই উত্তরটি তোমাকে সহযোগিতা করবে।
উচ্চ মাধ্যমিক স্তরের সরকারি বেসরকারি মাদ্রাসা ও কলেজ সমূহে অধ্যয়নরত শিক্ষার্থীদের ৬ষ্ঠ সপ্তাহের অ্যাসাইনমেন্ট ইতোমধ্যে প্রকাশিত হয়েছে। উচ্চ মাধ্যমিক স্তরের কলেজ ও মাদ্রাসায় অধ্যয়নরত দ্বাদশ শ্রেণির শিক্ষার্থীদের ৬ষ্ঠ সপ্তাহে রসায়ন ১ম পত্রের এসাইনমেন্ট এর একটি বাছাইকরা নমুনা উত্তর তোমাদের জন্য প্রস্তুত করে দেয়া হলো।
আলিম পরীক্ষা ২০২২ ৬ষ্ঠ সপ্তাহের অ্যাসাইনমেন্ট রসায়ন ১ম পত্র
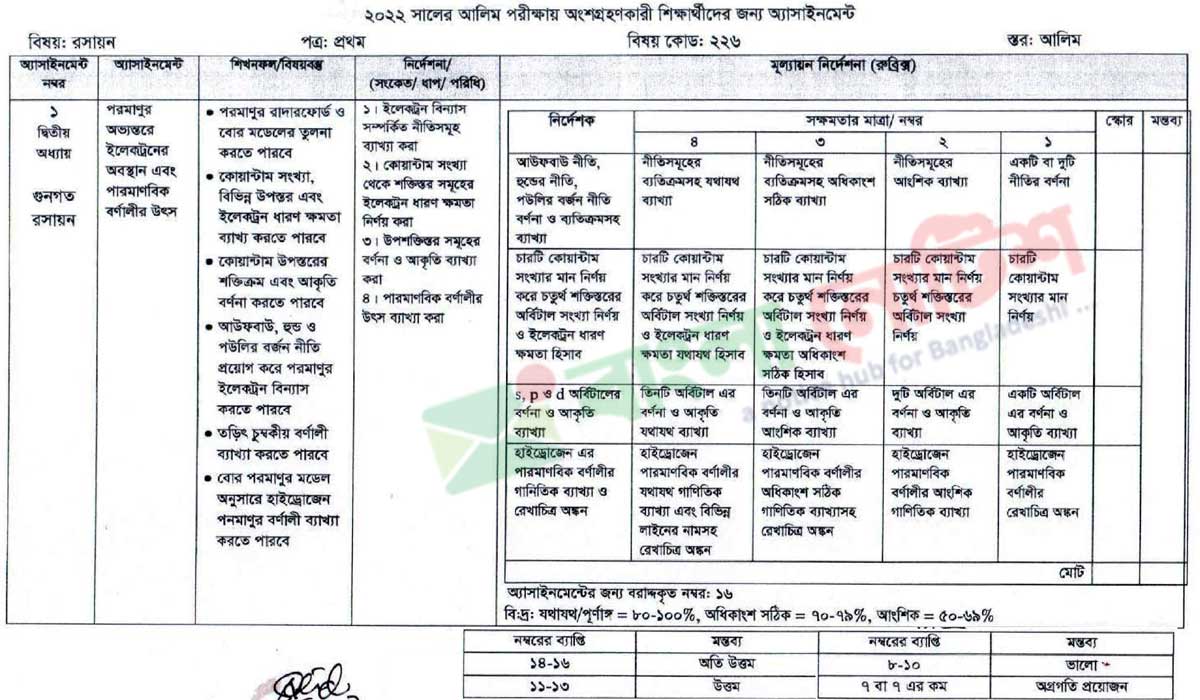
শ্রেণিঃ আলিম ২য় বর্ষ, বিভাগঃ বিজ্ঞান, বিষয়ঃ রসায়ন, অ্যাসাইনমেন্ট নং-০১, দ্বিতীয় অধ্যায়- গুণগত রসায়ন
অ্যাসাইনমেন্টঃ পরমাণুর অভ্যন্তরে ইলেকট্রনের অবস্থান এবং পারমাণবিক বর্ণালীর উৎস;
শিখনফল/বিষয়বস্তুঃ
- ১. পরমাণুর রাদারফোর্ড ও বাের মডেলের তুলনা করতে পারবে।
- ২. কোয়ান্টাম সংখ্যা, বিভিন্ন উপস্তর এবং ইলেকট্রন ধারণ ক্ষমতা ব্যাখ্য করতে পারবে
- ৩. কোয়ান্টাম উপস্তরের শক্তিক্রম এবং আকৃতি বর্ণনা করতে পারবে।
- ৪. আউফবাউ, হুন্ড ও পউলির বর্জন নীতি প্রয়ােগ করে পরমাণুর ইলেকট্রন বিন্যাস করতে পারবে।
- ৫. তড়িৎ চুম্বকীয় বর্ণালী ব্যাখ্যা করতে পারবে।
- ৬. বাের পরমাণুর মডেল অনুসারে হাইড্রোজেন পনমাণুর বর্ণালী ব্যাখ্যা করতে পারবে।
নির্দেশনা (সংকেত ধাপ/ পরিধি):
- ১। ইলেকট্রন বিন্যাস সম্পর্কিত নীতিসমূহ ব্যাখ্যা করা;
- ২। কোয়ান্টাম সংখ্যা থেকে শক্তিস্তর সমূহের ইলেকট্রন ধারণ ক্ষমতা নির্ণয় করা;
- ৩। উপশক্তিস্তর সমূহের বর্ণনা ও আকৃতি ব্যাখ্যা করা;
- ৪। পারমাণবিক বর্ণালীর উৎস ব্যাখ্যা করা;
এইচএসসি, আলিম শ্রেণির ৬ষ্ঠ সপ্তাহের অ্যাসাইনমেন্ট রসায়ন ১ম পত্রের বাছাইকৃত নমুনা উত্তর
গুণগত রসায়ন হল রসায়ন পাঠের একটি অতি গুরুত্বপূর্ণ পাঠ। গুণগত রসায়ন পাঠে আমরা কোনো যৌগে কোনো মৌল বা মূলক বা যৌগ কি পরিমাণে আছে তা নির্ণয় করতে পারি। এছাড়াও গুণগত রসায়নে আমরা পদার্থের অভ্যন্তরীণ গঠন, বর্ণালী, সনাক্তকরণ পরীক্ষা, মৌল বা যৌগের পৃথকীকরণ, ক্রোমাটোগ্রাফি ইত্যাদি সম্পর্কে গুরুত্বপূর্ণ বিষয় আলোচিত হয়। সুতরাং এ কথা অনস্বীকার্য যে, রসায়নে গুণগত রসায়ন এর গুরুত্ব অপরিসীম।
ইলেকট্রন বিন্যাস সম্পর্কিত নীতিসমূহ
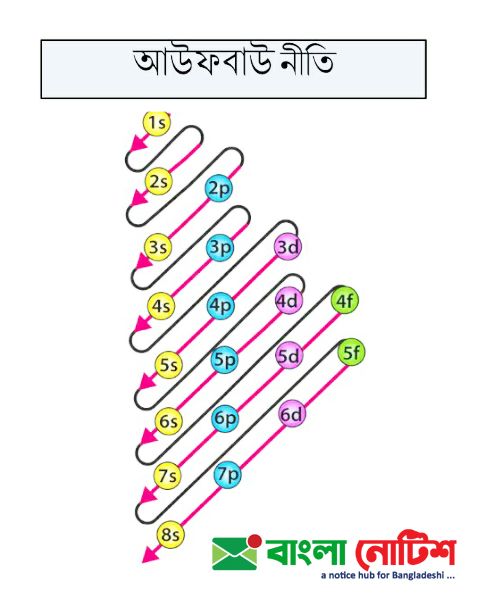
আউফবাউ নীতি :
আউফবাউ নীতি কোনো পরমাণু বা আয়নের ইলেকট্রনের বিন্যাস বা কনফিগারেশন নির্ধারণে ব্যবহৃত হয়। এটি 3d ও 4s অরবিটালদ্বয়ের ইলেকট্রন ধারণক্ষমতার ধারাবাহিকতা প্রকাশ করে। আউফবাউ (aufbau) একটি জার্মান শব্দ, যার অর্থ নির্মাণ করা বা উপরে যাওয়া। এ নীতি হলো:
“কোনো পরমাণুর ইলেক্ট্রনসমূহ তাদের শক্তির উচ্চক্রম অনুসারে প্রবেশ করবে।” এ নীতি অনুসারে সামগ্রিকভাবে ইলেকট্রনসমূহ বিভিন্ন অরবিটালে তাদের শক্তির উচ্চক্রম অনুসারে প্রবেশ করে। অর্থাৎ ইলেকট্রন প্রথমে নিম্ন শক্তির অরবিটালে এবং পরে ক্রমান্বয়ে উচ্চ শক্তির অরবিটালসমূহে প্রবেশ করে, কারণ নিম্ন শক্তির স্তরের স্থিতিশীলতা বেশি।
কোন অরবিটালের শক্তি কত তা প্রধান কোয়ান্টাম সংখ্যা ‘n’ এবং সহকারী কোয়ান্টাম সংখ্যা ‘l’-এর মান থেকে হিসেবে করা হয়। যে অরবিটালের জন্য (n +l ) এর মান কম সেটিই নিম্ন শক্তির অরবিটাল এবং ইলেকট্রন তাতেই প্রথম প্রবেশ করে। যেমন–
- 3d অরবিটালের জন্য, n = 3 এবং l = 2 ∴ (n + l) = 3 + 2 = 5
- 4s অরবিটালের জন্য, n = 4 এবং l = 0 ∴ (n + l) 4 + 0 = 4
সুতরাং 3d-এর চেয়ে 4s এর শক্তি কম বলে (4s < 3d) ইলেকট্রন আগে 4s অরবিটালে প্রবেশ করে এবং সেটি পূর্ণ হলে 3d অরবিটালে যায়।
কিন্তু যদি দুটি অরবিটালের ক্ষেত্রে (n + l) এর মান সমান হয় তবে তাদের মধ্যে যে অরবিটালের ‘n’-এর মান নিম্ন অর্থাৎ প্রধান শক্তিস্তর নিম্নতর ইলেকট্রন তাতেই আগে প্রবেশ করে। যেমন–
- 3d অরবিটালের জন্য, n = 3 এবং l = 2 ∴ (n + l) = 3 + 2 = 5
- 4p অরবিটালের জন্য, n = 4 এবং l = 1 ∴ (n + l) 4 + 1 = 5
সুতরাং এ দুটি অরবিটালের (n + l) এর মান সমান। তবে 4p অপেক্ষা 3d অরবিটালের n-এর মান কম। তাই 4p অপেক্ষা 3d অরবিটালের শক্তিও কম। এজন্য ইলেকট্রন আগে 3d অরবিটালে ও তা পূর্ণ হলে পরে 4p অরবিটালে প্রবেশ করে।
পারমাণবিক বর্ণালী বিশ্লেষণ করে বিভিন্ন অরবিটালের আপেক্ষিক শক্তিক্রম নির্ণয় করা হয়। তারপর আউফবাউ এর নীতি অনুসারে ইলেকট্রন বিন্যাসের জন্য চূড়ান্তভাবে অরবিটালগুলোকে নিচের সাজানো হয়েছে।
হুন্ডের নিয়মঃ
যেমন-
N (7) = 1s² 2s² 2px1 2py1 2pz1
সম শক্তিসম্পন্ন বিভিন্ন অরবিটালে ইলেকট্রনগুলো এমনভাবে অবস্থান করবে যেন তারা সর্বাধিক অযুগ্ম বা বিজোড় অবস্থায় থাকতে পারে। এই সব অযুগ্ম ইলেকট্রনের স্পিন একমুখী হবে।”-
হুন্ডের নীতির ব্যাখ্যা
ব্যাখ্যাঃ হুন্ডের নিয়মটি N(7) পরমাণুর ইলেকট্রন বিন্যাসে দেখানো হল৷ নাইট্রোজেনের ইলেকট্রন বিন্যাস-N (7) = 1s² 2s² 2p³ আবার 2p অরবিটালে সমশক্তিসম্পন্ন তিনটি অরবিটাল আছে, যেটি কোয়ান্টাম উপশক্তিস্তর আকার আকৃতি থেকে জানা যায় যে p অরবিটালের আকৃতি আসলে ত্রিমাত্রিক ডাম্বেল আকৃতির, 2p অরবিটালের তিনটি অরবিটাল আছে; এদেরকে px, py, pz অরবিটাল হিসেবে চিহ্নিত করা হয়৷ সুতরাং নাইট্রোজেনের বেলায় 2p³ এর তিনটি ইলেকট্রন তিনটি সমশক্তির অরবিটালে আলাদা আলাদাভাবে থাকবে এবং এদের স্পিনসমূহের দিক একইমুখী হবে।
পলির বর্জন নীতি
একই পরমাণুতে যে কোন দুটি ইলেকট্রনের চারটি কোয়ান্টাম সংখ্যার মান কখনোও একই হতে পারেনা। দুটি ইলেকট্রনের ৩টি কোয়ান্টাম সংখ্যার মান একই হলে চতুর্থ কোয়ান্টাম সংখ্যা অবশ্যই ভিন্ন হবে।
যেমনঃ- দুটি ইলেকট্রন বিশিষ্ট একটি পরমাণুতে –
১ম ইলেকট্রনের জন্য, n = 1, l = 0, m = 0, s = + ,
২য় ইলেকট্রনের জন্য, n = 1, l = 0, m = 0, s = – ,
অর্থাৎ একই পরমাণুর ২টি ইলেকট্রনের কক্ষপথের আকার (n), আকৃতি ( l ), কৌণিক অবস্থান (m) একই হতে পারে যদি তাদের নিজ অক্ষের উপর ঘুর্ননের দিক পরস্পর বিপরীতমুখী হয়। সুতরাং পলির বর্জন নীতির মূলকথা হলো- ” একটি পারমাণবিক অরবিটালে সর্বাধিক দুটি ইলেকট্রন থাকতে পারে যদি তাদের ঘুর্নন বা স্পিন বিপরীত মুখী হয়।
অরবিটালে শক্তি নির্ণয়: (কিছু প্রয়ােজনীয় তথ্য)।
- যে অরবিটালের n + 1 এর মান বেশি সেই অরবিটাল বেশি শক্তি সম্পন্ন। যেমন: 3d এর ক্ষেত্রে (n + 1) = 3 + 2 = 5; 4s এর ক্ষেত্রে (n + /) = 4 + 0 = 4। সুতরাং 3d এর চেয়ে 4s এর শক্তি কম। তাই ইলেকট্রন কম শক্তির অরবিটাল অর্থাৎ 4s এ আগে প্রবেশ করবে এবং অতঃপর 3d তে প্রবেশ করবে।
- n + 1 এর মান সমান হলে যে অরবিটালের n এর মান বেশি, সে অরবিটাল বেশি শক্তিসম্পন্ন। যেমন: 2p এর ক্ষেত্রে (n + 1) = 2 + 1 = 3; 3s এর ক্ষেত্রে (n + /) = 3 + 0 = 3.
- উভয়েরই n +l এর মান সমান কিন্তু n এর মান 2p এর চেয়ে 3s এর বেশি। সুতরাং ইলেকট্রন কম শক্তিসম্পন্ন অরবিটাল অর্থাৎ 2p তে আগে প্রবেশ করবে।
অরবিটাল গুলাের শক্তিক্রম নিম্নরূপ:
ls < 2s < 2p <3s < 3p <4s < 3d <4p < 5s < 4d < 5p < 6s <4f < 5d < 6p <7s < 5f < 6d <7p < 8s
কোয়ান্টাম সংখ্যা বর্তমানে বহুল আলোচিত একটি বিষয়৷ কোয়ান্টাম সংখ্যা ছাড়া অনু-পরমাণু সর্ম্পকে জ্ঞান অর্জন সম্ভব নয়।
কোয়ান্টাম সংখ্যার প্রকারভেদ
- ১. প্রধান কোয়ান্টাম সংখ্যা(n)
যে কোয়ান্টাম সংখ্যার সাহায্যে পরমাণুতে অবস্থিত ইলেকট্রনের শক্তিস্তরের আকার নির্ণয় করা যায় তাকে প্রধান কোয়ান্টাম সংখ্যা বলে। একে n দ্বারা প্রকাশ করা হয়,n এর মান যথাক্রমে 1,2,3,4….. প্রভৃতি পূর্ণ সংখ্যা। প্রধান কোয়ান্টাম সংখ্যার মান বৃদ্ধি হলে নিউক্লিয়াস হতে প্রধান স্তরের দুরত্ব এবং শক্তিস্তরের আকার বৃদ্ধি পায়। বোর মতবাদ অনুসারে n=1 হলে ১ম শক্তিস্তর বা K শেল, n=2 হলে ২য় শক্তিস্তর বা L শেল, n=3 এবং n=4 হলে M ও N ইত্যাদি বোঝায়। যে কোনো প্রধান শক্তিস্তর সর্বোচ্চ 2n² ইলেকট্রন ধারণ করতে পারে। - ২. গৌন কোয়ান্টাম সংখ্যা(l)
যে কোয়ান্টাম সংখ্যার সাহায্যে শক্তিস্তরের আকৃতি নির্ণয় করা যায় তাকে সহকারী কোয়ান্টাম সংখ্যা বলে। সহকারী কোয়ান্টাম সংখ্যা,l এর মান 0 থেকে (n-1) পর্যন্ত হতে পারে। বোরের তত্ত্বে পরমাণু ছিল বর্তুলাকার। কিন্তু সোমারফিল্ড দেখান যে, কক্ষপথ উপবৃত্তাকারও হতে পারে। তাছাড়া, হাইড্রোজেন পরমাণুর বর্ণালীর প্রতিটি রেখা আসলে ক্ষুদ্র ক্ষুদ্র অংশে বিভক্ত ছিলো। সোমারফিল্ড বললেন যে প্রতিটি অরবিট বা প্রধান শক্তিস্তর n সংখ্যক ভাগে বিভক্ত যাদের মধ্যে শক্তির সূক্ষ্ম পার্থক্য আছে। এর ফলেই সূক্ষ্ম রেখাগুলো দেখা যায়।
পরমাণুর অভ্যন্তরে ইলেকট্রনের অবস্থান এবং পারমাণবিক বর্ণালীর উৎস
- ৩. চৌম্বকীয় কোয়ান্টাম সংখ্যা (m)
যে সকল কোয়ান্টাম সংখ্যার সাহায্যে ইলেকট্রনের কক্ষপথের ত্রিমাত্রিক দিক বিন্যাস প্রকরণ সমূহ প্রকাশ করা হয়, তাকে ম্যাগনেটিক কোয়ান্টাম সংখ্যা বা চুম্বকীয় কোয়ান্টাম সংখ্যা বলে। চুম্বকীয় কোয়ান্টাম সংখ্যা, m এর মান -l থেকে l এর পর্যন্ত পূর্ণসংখ্যা। নন-ডিজেনারেট অবস্থায় অরবিটালসমূহ সমশক্তির, তবে চুম্বকক্ষেত্রে রাখলে শক্তির পার্থক্য তৈরি হয়। আর বলা বাহুল্য, z অক্ষ বরাবর অরবিটাল, যেমন p_z, d-z² এর বেলায় m=0 - ৪. ঘূর্ণন কোয়ান্টাম সংখ্যা(s)
নিজস্ব অক্ষের চারদিকে ইলেকট্রনের ঘুর্ণনের দিক প্রকাশক কোয়ান্টাম সংখ্যা সমূহকে স্পিন কোয়ান্টাম সংখ্যা বা ঘূর্ণন কোয়ান্টাম সংখ্যা বলে। এই কোয়ান্টাম সংখ্যা, s, ফার্মিয়ন কণার বেলায় তা ±½ এর গুণিতক। ইলেক্ট্রনের বেলায় তা ½.
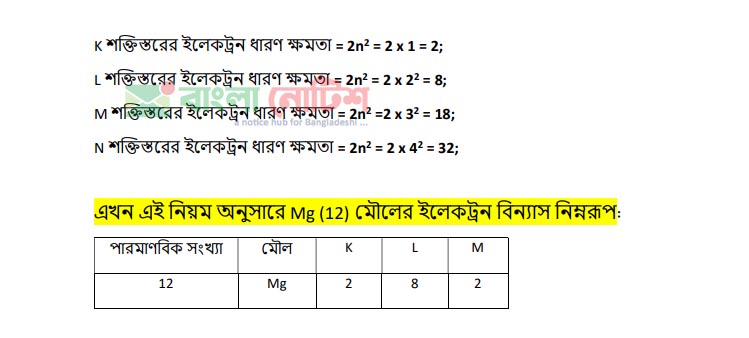
একটি মৌলের (Mg) কথা চিন্তা করি যার পারমাণবিক সংখ্যা 12। অর্থাৎ মৌলটির একটি পরমাণুতে 12টি প্রােটন আছে। আবার প্রতিটি প্রােটন +1 চার্জ বিশিষ্ট, ফলে পরমাণুটি +12 চার্জ বিশিষ্ট হওয়ার কথা কিন্তু পরমাণু চার্জ নিরপেক্ষ অথাৎ পরমাণুর মধ্যে প্রােটন সংখ্যার সমান সংখ্যক ইলেকট্রন বিদ্যমান, তার অর্থ পরমাণুটিতে 12টি ইলেকট্রন (-1 চার্জবিশিষ্ট) বিদ্যমান। এখন প্রশ্ন হচ্ছে পরমাণুর মধ্যে ইলেকট্রনগুলাে কিভাবে বিন্যস্ত আছে? এগুলাে কি এক সাথে আছে নাকি বিচ্ছিন্ন অবস্থায় আছে?
পরমাণুর অভ্যন্তরে ইলেকট্রনের অবস্থান এবং পারমাণবিক বর্ণালীর উৎস
ইলেকট্রনগুলাে পরমাণুর বিভিন্ন শক্তিস্তর বা কক্ষপথে ঘূর্ণায়মান আছে। প্রতিটি শক্তিস্তরের মধ্যে শক্তি বা energy এর পার্থক্য বিদ্যমান, এ সমস্ত বিভিন্ন শক্তিস্তরের বিভিন্ন নাম আছে, যেমন: K, L, M, N, O ……. ইত্যাদি। প্রথম শক্তিস্তর হলে তাকে K, দ্বিতীয় শক্তিস্তর হলে তাকে L, তৃতীয় শক্তিস্তর হলে M ইত্যাদি নামে আখ্যায়িত করা হয়।
এই সমস্ত শক্তিস্তরের ইলেকট্রন ধারণ ক্ষমতা বিভিন্ন হয়। একটি শক্তিস্তরে সর্বোচ্চ কতগুলাে ইলেকট্রন থাকতে পারে তা 2n² সূত্র দ্বারা বের করা যায়, যেখানে n হচ্ছে শক্তিস্তরের সংখ্যা যেমন: 1, 2, 3 ইত্যাদি পূর্ণ সংখ্যা।
নিচে বিভিন্ন শক্তিস্তরে সর্বোচ্চ ইলেকট্রন ধারণ ক্ষমতা দেওয়া হল :
হাইড্রোজেন থেকে আর্গন পর্যন্ত মৌলগুলাের ইলেকট্রন বিন্যাস এই নিয়মে করা যায়। কিন্তু 18 এর বেশি পারমাণবিক সংখ্যা বিশিষ্ট মৌল গুলাের . ইলেকট্রন বিন্যাস এই নিয়মে হয় না। যেমন: আয়রন (Fe) এর একটি পরমাণুতে 26 টি ইলেকট্রন বিদ্যমান এবং পূর্বের নিয়ম অনুসারে এর ইলেকট্রন বিন্যাস হওয়া উচিত 2, 8, 16 । কিন্তু প্রকৃতপক্ষে Fe(26) এর ইলেকট্রন বিন্যাসটি নিম্নরূপ:
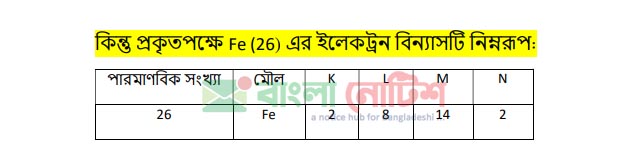
দেখা যাচ্ছে ইলেকট্রন আগের শক্তিস্তর সম্পূর্ণ পূরণ না করেই পরের শক্তিস্তরে চলে গেছে। এই ঘটনা ব্যাখ্যার জন্য আমাদের অরবিটাল বা উপস্তরের ধারণা লাগবে।
প্রতিটি প্রধান শক্তিস্তর এক বা একাধিক উপস্তর (orbital) নিয়ে গঠিত। এদেরকে s, p, d, f …… ইত্যাদি নামে নামকরণ করা হয় এই সমস্ত অরবিটালের একদিকে যেমন শক্তির তারতম্য আছে ঠিক অন্য দিকে এদের ইলেকট্রন ধারণ ক্ষমতা ভিন্ন হয়।।
এখন ইলেকট্রন বিন্যাসের সময় ইলেকট্রন কোন উপস্তরে আগে যাবে তা জানার জন্য আমাদের একটি সূত্র জানতে হবে। ইলেকট্রন বিন্যাসের সময় ইলেকট্রনসমূহ তাদের বিভিন্ন অরবিটালে তাদের শক্তির নিম্নক্রম থেকে উচ্চক্রম অনুসারে প্রবেশ করে (আউফবাউ নীতি)।
নিচে বিভিন্ন উপশক্তিস্তরের ইলেকট্রন ধারণ ক্ষমতা দেওয়া হলাে:

L হলাে সহকারী কোয়ান্টাম নম্বর। এখানে অরবিটালের শক্তি নির্ণয়ের জন্য প্রতিটি উপস্তরের মান দেওয়া হলাে।
কোয়ান্টাম উপস্তরের শক্তিক্রম
অরবিট
বোর পরমাণুবাদ মতে নিউক্লিয়াসের চারপাশে ইলেকট্রন কতগুলো অনুমোদিত গোলাকার কক্ষপথে/শক্তিস্তরে আবর্তিত হয় । এদের অরবিট বলে। প্রতিটি শক্তিস্তরে নির্দিষ্ট সংখ্যক (2n²) ইলেকট্রন থাকে। কোয়ান্টাম মতবাদের উপর ভিত্তি করেই অরবিটের ধারণা প্রতিষ্ঠিত।
অরবিটাল
পরমাণুর ভেতর যে ত্রিমাত্রিক জায়গা জুড়ে ইলেকট্রন এর ঘনত্ব বেশি, তাই অরবিটাল ।
একটি পরমাণুর শক্তিস্তর বা ইলেকট্রনের শক্তিস্তরকে (সাধারণভাবে প্রধান শক্তিস্তর নামে পরিচিত) পরমাণুর নিউক্লিয়াসের চারিদিকে ঘূর্ণায়মান ইলেক্ট্রনের কক্ষপথ বলা যেতে পারে। এটি মূলতঃ পারমাণবিক অরবিটালসমূহের একটি গ্রুপ যাদের প্রধান কোয়ান্টাম সংখ্যার (n) মান সর্বদাই সমান। ইলেকট্রনের শক্তিস্তর এক বা একাধিক উপশক্তিস্তর নিয়ে গঠিত হয়। প্রতিটি উপশক্তিস্তরে আবার দুই বা ততোধিক অরবিটাল থাকে যাদের কৌণিক ভরবেগ কোয়ান্টাম সংখ্যার মান ১। অর্থাৎ একই। এই শক্তিস্তরগুলোই একটি পরমাণুর ইলেকট্রন বিন্যাস তৈরি করে।
পরমাণুর অভ্যন্তরে ইলেকট্রনের অবস্থান এবং পারমাণবিক বর্ণালীর উৎস।
শক্তিস্তর সহ পর্যায় সারণী
প্রতিটি শক্তিস্তর একটি নির্দিষ্ট সংখ্যক ইলেকট্রন ধারণ করতে পারে। সে কারণে প্রতিটি শক্তিস্তর একটি নির্দিষ্ট সীমার ইলেক্ট্রন শক্তির সাথে সম্পর্ক যুক্ত, আর তাই পরমাণুর ভেতরদিকের প্রতিটি শক্তিস্তর প্রয়োজনীয় ইলেক্ট্রন দ্বারা পরিপূর্ণ না হলে পরবরতী শক্তিস্তরে (বাইরের দিকের) ইলেক্ট্রন যেতে পারে না। পরমাণুর সবচেয়ে বাইরের শক্তিস্তরে পরিভ্রমণরত ইলেক্ট্রন দ্বারা ঐ পরমাণুর বৈশিষ্ট নির্ধারিত হয়ে থাকে ।
উপশক্তিস্তর সমূহের বর্ণনা ও আকৃতি ব্যাখ্যা
অরবিটালকে সাধারণত বাংলায় উপশক্তিস্তর বলা হয়ে থাকে যা একটি প্রচলিত ভুল। একটু সহজ করে যদি বলি,
সাবশেল বা উপশক্তিস্তর হল কোন একটি অরবিটে বা কক্ষপথে অবস্থিত এলাকা যেখানে ইলেকট্রন পাওয়ার সম্ভাবনা রয়েছে। আর অরবিটাল হলো উক্ত এলাকায় অবস্থানরত ইলেকট্রন সমূহের ত্রিমাত্রিক দিক বিন্যাস প্রকাশ করার গানিতিক মাধ্যম।
সুতরাং বলা যায়,কোন পরমাণুর কোন নির্দিষ্ট অরবিটে একটি ইলেকট্রনকে খুঁজে পাওয়ার সম্ভ্যাব এলাকা কে আমরা উপশক্তিস্তর বা সাব-অরবিট বলতে পারি এবং উক্ত এলাকায় অবস্থানরত ইলেকট্রনটির ত্রিমাত্রিক দিক বিন্যাসের ধারনা আমরা অরবিটাল থেকে পাই।
যেমন : সহকারী কোয়ান্টাম সংখ্যা-
- 1 কে s অরবিটাল দ্বারা প্রকাশ করা হয়।
- 2 কে p অরবিটাল দ্বারা প্রকাশ করা হয়।
- 3 কে d অরবিটাল দ্বারা প্রকাশ করা হয়।
- 4 কে f অরবিটাল দ্বারা প্রকাশ করা হয়।
পারমাণবিক বর্ণালীর উৎস ব্যাখ্যা
কোনো পরমানুর উপর অতিবেগুনী, দৃশ্যমান ও অবলোহিত অঞ্চলের শক্তি আপতিত হলে ঐ পরমানুর যোজনী স্তরের ইলেকট্রন নিম্ন শক্তি স্তর থেকে উচ্চ শক্তি স্তরে গমনের সময় শক্তি শোষণ ও বিকিরণ ঘটে আর এর ফলে যে সরু রেখা বা বর্ণালীর সৃষ্টি হয়, তাকে পারমাণবিক বর্ণালী বলে।
বিজ্ঞানীরা বর্ণালীকে দুই ভাগে ভাগ করে ফেললেন। নিরবিচ্ছন্ন বর্ণালী ও রেখা বর্ণালী। নিবিচ্ছিন্ন বর্ণালী হলো তাপীয় বর্ণালী। কঠিন বস্তুকে উত্তপ্ত করলে তা থেকে বিকিরণ নিঃসরণ করে। এসব বর্ণালীতে সবগুলো তরঙ্গ দৈর্ঘ্যের বর্ণ থাকে। কেনো বিভাজন রেখা থাকে না এসব বর্ণালীতে। তাই এদেরকে বিচ্ছিন্ন বর্ণালী বলে। এরা কিন্তু পারমাণবিক বর্ণলী নয়। তাই নিরবিচ্ছিন্ন বর্ণালী নিয়ে আমরা বেশি কথা বলব না।
নিন্মচাপে গ্যাসের ভেতর দিয়ে বিদ্যুৎ প্রবাহিত করলে গ্যাসের অণু-পরমাণুগুলো উত্তেজিত হয়ে ওঠে। এসব উত্তেজিত পরমাণু বিকিরণ নিঃসরণ করে। তবে এ ধরনের বিকিরণ সব তরঙ্গ দৈর্ঘ্যরে বিকিরণ নিঃসরণ করতে পারে না। তাই এ ধরনে বর্ণালীতে বিচ্ছিন্ন রেখা দেয়। এজন্য এদেরকে বিচ্ছিন্ন বর্ণালী বলে। এদের নিয়েই আমাদের যত কারবার। সুতরাং এদের ঠিকুজি-কোষ্ঠি জেনে নেওয়া জরুরি।
পরমাণুর অভ্যন্তরে ইলেকট্রনের অবস্থান এবং পারমাণবিক বর্ণালীর উৎস
একটা মৌলিক পদার্থের সবগুলো পরমাণুই একই ধরনের রেখা বর্ণালী তৈরি করে। আবার একটা মৌলের পরমাণু একটা রঙের বর্ণালী তৈরি করবে তা কিন্তু নয়। একটা পরমাণু একাধিক রঙের বর্ণালী তৈরি করতে পারে। এক মৌলের বর্ণালীর সাথে অন্য মৌলের বর্ণালী হুবহু মেলে না। কয়েকটা রেখা হয়তো মিলতে পারে। রেখা বর্ণালীর এই বৈশিষ্ট্যলো ম্যাক্সওয়েল লক্ষ্য করেছিলেন। লক্ষ্য করেছিলেন বোলৎজম্যানও। তবে এটা নিয়ে ব্যাপক গবেষণা করেন ব্রিটিশ বিজ্ঞানী জোসেফ নরম্যান লকইয়ার। ১৯৭৪ সালে। তিনিই মূলত রেখা বর্ণালীর বৈশিষ্ট্যগুলো লিপিবদ্ধ করে যান।
আমরা বলেছি, হ্যানস হ্যানসেন, বোরকে বামার সিরিজের কথা জানিয়েছিলেন। কিন্তু বামার সিরিজ কীভাবে এলো সেটাও জানা দরকার। জোহান জ্যাকব বামার ছিলেন সুইজ্যারল্যান্ডের নামকরা গণিতবিদ। তিনি গণিত পড়াতেন একটা স্কুলে। আবার ছিলেন একটা বিশ্ববিদ্যালয়ের খন্ডকালীন শিক্ষকও। এক সহাকর্মী তাঁকে হাইড্রেজন পরমাণুর চারটি বর্ণালী রেখার খোঁজ দেন। উত্তেজিত হাইড্রেজেন পরমাণু যে বিকিরণ নিঃসরণ করে তা থেকেই তৈরি হয় এই চারটি বর্ণালী রেখা। লাল, সবুজ, নীল ও বেগুনী।
পরমাণুর অভ্যন্তরে ইলেকট্রনের অবস্থান এবং পারমাণবিক বর্ণালীর উৎস
১৮৫০ সালে এই রেখা আবিষ্কার করেন সুইডিশ বিজ্ঞানী অ্যান্ডার্স জোনস অ্যাংস্ট্রম। নামটা চেনা চেনা লাগছে? আলোর তরঙ্গ দৈর্ঘ্যরে খুব ক্ষুদ্র এককের নাম অ্যাংস্ট্রম। ওই বিজ্ঞানীর নামানুসারেই। তো অ্যাংস্ট্রম হাইড্রোজেন বর্ণালীর চারটি রেখার তরঙ্গ দৈর্ঘ্যও মাপতে সক্ষম হলেন। তিনি হাইড্রোজেন বর্ণালী চারটি বর্ণেরই নামকরণ করলেন। লাল বর্ণের রেখাটির নাম দিলেন, সবুজ রেখাটির, নীল রেখাটির এবং বেগুনি রেখাটির নাম দিলেন। এদের তরঙ্গ দৈর্ঘ্য পেলেন যথাক্রমে ৬৫৬.৩, ৪৮৬.১, ৪৩৪.১ ও ৪১০.২ ন্যানোমিটার।
হাইড্রোজেন পরমাণুর রেখা বর্ণালী
এত কিছু করলেন অ্যাংস্ট্রম কিন্তু এই রেখাগুলোর জন্য কোনো গাণিতিক সমীকরণ তৈরি করে যেতে পারেননি। বন্ধুর কথা শুনে সেই কাজেই হাত লাগালেন বামার। তিনি গাণিতিক সূত্র তৈরি করলেন এদের জন্য। সেই সূত্রের সাহায্যে ফের তরঙ্গ দৈর্ঘ্য বের করলেন রেখাগুলোর। আশ্চর্যের বিষয়, চারটি রেখার জন্য অ্যাংস্ট্রম যে যে তরঙ্গ দৈর্ঘ্য পেয়েছিলেন, বামার সেই মানই পেলেন। একচুলও এদিক-ওদিক হলো না। তারপর থেকে ওই রেখাগুলোর সাধারণ নাম হয়ে গেল বামার সিরিজ।
জোহান জ্যাকব বামার
বামারের সমীকরণের আদলে আরেকটি সমীকরণ তৈরি করেন আরেক সুইডিশ বিজ্ঞানী জোহান রবার্ট রিডবার্গ। এজন্য তিনি একটা ধ্রুবকের আশ্রয় নেন। সেই ধ্রবকের নামকরণ হয়ে যায় তাঁর নামানুসারে রিডবার্গ ধ্রুবক। রিডবার্গ সমীকরণের সুবিধা হলো, শুধু ওই চারটি বর্ণলীর তরঙ্গ দৈর্ঘ্যই নয়, যেকোনো দৃশ্যমান বর্ণালীর তরঙ্গ দৈর্ঘ্য নির্ণয় করা যায়।
অ্যান্ডার্স জোনস অ্যাংস্ট্রম
বামার কিংবা রিডবার্গের সমীকরণেও কিন্তু সীমাবদ্ধতা রয়ে গেল। আগে আমরা দৃশ্যমান বর্ণালীর কথাই শুধু জানতাম। কিন্তু দৃশ্যমান বর্ণালীর বাইরেও তো আলো রয়েছে। সেসব আলো আলো দেখতে পাই না আমরা। যেমন লালের চেয়ে বেশি তরঙ্গ দৈর্ঘ্যের আলো হচ্ছে অবলোহিত রশ্মি, বেতার তরঙ্গ ইত্যাদি। তেমনি অতি বেগুনি রশ্মি, গামা রশ্মি ইত্যাদি আলোর তরঙ্গ দৈর্ঘ্য বেগুনি আলোর চেয়ে কম। এখন যদি কোনো পরমাণু অতিবেগুনী কিংবা অবলোহিত রশ্মি বিকিরণ করে তাহলে তাদের জন্য বর্ণালী সূত্র কেমন হবে? বামার কিংবা রিডবার্গ সমীকরণের সাহায্যে সেগুলোর ব্যাখ্যা করা সম্ভব নয়।
দৃশ্যমান আলোর বাইরের অঞ্চলের বর্ণালীর ব্যাখ্যার জন্য বেশ কয়েকটি সমীকরণ আবিষ্কার করেন বিজ্ঞানীরা।
যুক্তরাষ্ট্রের পদার্থবিদ থিওডর লাইম্যান জন্ম দেন লাইম্যান সিরিজের। এই সমীকরণের সাহায্যে অতি বেগুনি রশ্মি অঞ্চলের বর্ণালীর তরঙ্গ দৈর্ঘ্য নির্ণয় করা সম্ভব হলো। প্যাশেন সিরিজ নামের আরেক ধরনের সমীকরণ আবিষ্কার করলেন জার্মান বিজ্ঞানী ফ্রেডেরিখ প্যাশেন। তাঁর সমীকরণ দিয়ে অবলোহিত অঞ্চলের বর্ণালী রেখার তরঙ্গ দৈর্ঘ্য বের করা যায়। এছাড়াও অবলোহিত অঞ্চলের বর্ণালী রেখাগুলোর ব্যাখ্যার জন্য আরো দুটি সমিকরণ আবিষ্কার হয়। একটা ব্রাকেট সিরিজ, এর আবিষ্কর্তা যক্তরাষ্ট্রের পদার্থবিদ ফ্রেডেরিখ ব্রাকেট। অন্যদিকে হারম্যান ফান্ড আবিষ্কার করেন ফান্ড সিরিজ। রিডবার্গ সমীকরণকে একটু অন্যভাবে ব্যবহার করেন সুইস বিজ্ঞানী ওয়ালথার রিৎজ। তিনি তরঙ্গ দৈর্ঘ্যের বদলে বর্ণালীর কম্পাঙ্ক নির্ণয়ের একটা সমীকরণ দাঁড় করালেন। সমীকরণের নাম দেওয়া হয় রিডবার্গ-রিৎজ সমীকরণ।
পরমাণুর অভ্যন্তরে ইলেকট্রনের অবস্থান এবং পারমাণবিক বর্ণালীর উৎস।
মোটামুটি এগুলোই ছিল বর্ণালীবিজ্ঞানের গাণিতিক সূত্র। সেই সূত্রের দিকেই হাত বাড়ালেন বোর। তার পরমাণু মডেলে সংশোধন আনলেন। ইলেকট্রন এক শক্তিস্তর থেকে লাফ দিয়ে যখন আরেকটি শক্তিস্তরে যায় তখন যে শক্তি শোষণ অথবা নিঃসরণ করে তার মান প্ল্যাঙ্ক-আইনস্টাইনের কোয়ান্টাম তত্ত্ব থেকে বের করা যায়। সেটা। এখানে হলো যে শক্তি নিঃসৃত বা বিকিরিত হয়, তার কম্পাঙ্ক। তিনি বলেছিলেন শক্তিস্তরগুলি শক্তি নির্দিষ্ট ও বিচ্ছিন্নমানের। আবার পরমাণু থেকে নিঃসৃত বর্ণালীও বিচ্ছিন্ন। বামার সিরিজেই সেই বিচ্ছিন্ন রেখাগুলি পাওয়া গিয়েছিল। বোর ভাবলেন নিশ্চয়ই বামার সিরিজের বর্ণালীর সাথে তাঁর পরমাণুর মডেলের শক্তিস্তরের শক্তির একটা যোগসূত্র আছে। বোর সেটাই খুঁজে বের করার চেষ্টা করলেন। এবং পেয়েও গেলেন।
বোর বললেন, ইলেকট্রন যখন উচ্চ শক্তিস্তর থেকে নিন্ম শক্তিস্তরে যায় তখন শক্তি হিসেবে একটা নির্দিষ্ট শক্তির ফোটন নিঃসরণ করে। আবার যখন নিন্ম শক্তিস্তর থেকে উচ্চ শক্তিস্তরে যায় তখন ইলেকট্রন একটা নির্দিষ্ট শক্তির ফোটন নিঃসরণ করে। সেই ফোটনের শক্তি কতটুকু হবে সেটা নির্ভর করবে ফোটন কোন কক্ষপথ থেকে কোন কক্ষপথে লাফ দিচ্ছে তার ওপর। কিন্তু কোনো একটা নির্দিষ্ট কক্ষপথে ফোটন যখন অবস্থান করে তখন কোনো ফোটন শোষণ বা বিকিরণ করে না।এখন দেখা যাক কোয়ান্টাম লাফের সময় কী পরিমাণ শক্তি ইলেকট্রন শোষণ বা বিকিরণ করে।
পরমাণুর অভ্যন্তরে ইলেকট্রনের অবস্থান এবং পারমাণবিক বর্ণালীর উৎস।
ইলেকট্রনের মোট শক্তি ধরা যাক, যেকোনো কক্ষপথের শক্তি । তাই প্রথম শক্তিস্তরের শক্তি, দ্বিতীয় শক্তিস্তরের শক্তি ইত্যাদি লেখা যায়। এক শক্তিস্তর থেকে ইলেকট্রন আরেক শক্তিস্তরে লাফ দিতে যে পরিমাণ শক্তি শোষণ বা বিকিরণ করে তাঁর তার পরিমাণ, হলো, যে শক্তি ইলেকট্রন আলোকশক্তি অর্থাৎ ফোটন আকারে বিকিরণ করছে তাঁর কম্পাঙ্ক। কম্পাঙ্কের মান কিন্তু আমরা রিডবার্গ-রিৎজ সমীকরণ থেকে বের করতে পারি। বের করতে পারি তরঙ্গ দৈর্ঘের মানও। বোর সেটাই করলেন। দেখলেন একটা উত্তেজিত হাইড্রোজন পরমাণুর ইলেকট্রন যেসব শক্তি নিঃসরণ করে তার তরঙ্গ দৈর্ঘ্যের মান বামারের বের করা রেখা বর্ণালীর তরঙ্গ দৈর্ঘ্যরে সাথে হুবহু মিলে যায়। অর্থাৎ বোর নিশ্চিত হলেন বামার সিরিজে যেসব রেখা বর্ণালী দেখা যায়, তা মূলতঃ হাইড্রেজন পরমাণুর বিভিন্ন কক্ষপথে কোয়ন্টাম লাফ দেওয়ার সময় ইলেকট্রন সেসব আলো বিকিরণ করে।
এখন একটা প্রশ্ন হতে পারে। ইলেকট্রন এক শক্তিস্তর থেকে আরেক শক্তিস্তরে কোয়ান্টাম লাফ দেওয়ার সময় নির্দিষ্ট শক্তির একটাই মাত্র ফোটন শোষণ বা বিকিরণ করে। তারজন্য একটা নির্দিষ্ট তরঙ্গ দৈর্ঘ্যের বর্ণালী পাওয়ার কথা, কিন্তু হাইড্রোজেন পরমাণুর বর্ণালীতে চারটে রেখা কেন দেখা যায়?
পরমাণুর অভ্যন্তরে ইলেকট্রনের অবস্থান এবং পারমাণবিক বর্ণালীর উৎস
বোর বললেন, উত্তেজিত হাইড্রোজেন পরমাণু নিয়ে গবেষণার সময় সেখানে একটা মাত্র হাইড্র্রোজেন পরমাণু থাকে না। থাকে হাইড্রোজেন গ্যাসের কোনো টিউব। তাতে লক্ষ-কোটি হাউড্রোজেন পরমাণু থাকে। সবগুলো পরমাণু একইভাবে উত্তেজিত নয়। কেনোটা বেশি উত্তেজিত, কোনটার উত্তেজনা কম। তাই সব পরমাণু একই তরঙ্গ দৈর্ঘ্যরে বর্ণালী বিকিরণ করে না। তবে হাইড্রোজেন পরমাণুর ক্ষমতা নেই বামার সিরিজের বাইরে কোনো বর্ণালী বিকিরণ করে। তাই উত্তেজিত সব পরমাণুই চারটি বর্ণালীর যেকোনো একটি বর্ণালী বিকিরণ করে। সবগুলো পরমাণুর বর্ণালী মিলে চারটি বর্ণালী রেখা তৈরি করে।
এভাবেই বোর বামার সিরিজের সাথে তাঁর পরমাণু মডেলের মেলবন্ধন ঘটালেন। ব্যাখ্যা দিলেন হাইড্রোজেন পরমাণুর বামার সিরিজের ব্যাখ্যা। সেই সাথে উত্তর দিলেন বহবছর ধরে না পাওয়া একটা প্রশ্নের। সেটা হলো হাইড্রোজেন পরমাণুর বিকিরণের মূল উৎস কী। সাথে সাথে বামার সিরিজের বর্ণালীকেও কোয়ান্টাম তত্ত্বের আওতায় নিয়ে আসতে সক্ষম হলেন।
এই ছিল তোমাদের এইচএসসি, আলিম শ্রেণির ৬ষ্ঠ সপ্তাহের অ্যাসাইনমেন্ট রসায়ন ১ম পত্রের বাছাইকৃত নমুনা উত্তর- পরমাণুর অভ্যন্তরে ইলেকট্রনের অবস্থান এবং পারমাণবিক বর্ণালীর উৎস।
আরো দেখুন-
প্রতি সপ্তাহে সকল স্তরের অ্যাসাইনমেন্ট সংক্রান্ত সকল তথ্য পাওয়ার জন্য বাংলা নোটিশ এর ফেসবুক পেজটি লাইক এবং ফলো করে রাখুন ইউটিউব চ্যানেল সাবস্ক্রাইব করে রাখুন এবং প্লেস্টোর থেকে অ্যান্ড্রয়েড অ্যাপটি ডাউনলোড করে রাখুন।





