পরমাণুর মডেল ও ইলেকট্রন বিন্যাস, কোয়ান্টাম সংখ্যা
এইচএসসি ২০২১ এর বিজ্ঞান বিভাগের সুপ্রিয় পরীক্ষার্থী বন্ধুরা, তোমাদের জন্য প্রণীত এইচএসসি পরীক্ষা ২০২১ রসায়ন প্রথম পত্র ১ম অ্যাসাইনমেন্ট এর বাছাইকরা নমুনা উত্তর (পরমাণুর মডেল ও ইলেকট্রন বিন্যাস, কোয়ান্টাম সংখ্যা) প্রণয়ন করা হয়েছে। তোমরা যারা সরকারি, বেসরকারি কলেজের এইচএসসি ২০২১ পরীক্ষার্থী আছো তোমাদের ১ম সপ্তাহের এ্যাসাইনমেন্ট রসায়ন প্রথম পত্র বিষয়ের একটি নির্ধারিত কাজ দেয়া হয়েছিল। যথাযথ মূল্যায়ন নির্দেশনা অনুসরণ করে তোমাদের জন্য রসায়ন প্রথম পত্র ১ম এ্যাসাইনমেন্ট এর বাছাইকরা নমুনা উত্তর দেওয়া হল।
২০২১ সালের এইচএসসি পরীক্ষার রসায়ন ১ম অ্যাসাইনমেন্ট এর উত্তর বা সমাধান
এইচএসসি পরীক্ষার্থীদের রসায়ন বিষয়ের প্রথম এসাইনমেন্ট নেয়া হয়েছে পাঠ্য বইয়ের দ্বিতীয় অধ্যায় গুণগত রসায়ন থেকে। রসায়ন প্রথম পত্র প্রথম এসাইনমেন্টের সম্পন্ন করতে গিয়ে শিক্ষার্থীরা যে সকল বিষয়ে দক্ষতা অর্জন করবে তাহলো-
পরমাণুর রাদারফোর্ড ও বোর মডেলে তুলনা, কোয়ান্টাম সংখ্যা, বিভিন্ন স্তর এবং ইলেকট্রন ধারণক্ষমতা ব্যাখ্যা, কোয়ান্টাম উপস্তরের শক্তি এবং আকৃতির বর্ণনা, আউফবাউ, হুন্ড ও পাউলির বর্জন নীতি প্রয়োগ করে পরমাণুর ইলেকট্রন বিন্যাস করতে পারবে।
নিচে ২০২১ সালের এইচএসসি পরীক্ষার্থীদের রসায়ন বিষয়ের প্রথম অ্যাসাইনমেন্ট এর প্রশ্ন, সমাধান নির্দেশনা ও মূল্যায়ন নিয়ম সমূহ বিস্তারিত উল্লেখ করা হলো।
২০২১ সালের এইচএসসি পরীক্ষার রসায়ন ১ম অ্যাসাইনমেন্ট

স্তর: এইচএসসি পরীক্ষা ২০২১, বিভাগ: বিজ্ঞান, বিষয়ঃ রসায়ন, পত্র: প্রথম, বিষয় কোড-১৭৬, অ্যাসাইনমেন্ট নং-১
অধ্যায় ও শিরোনামঃ দ্বিতীয় অধ্যায়, গুণগত রসায়ন
অ্যাসাইনমেন্টঃ পরমাণুর মডেল ও ইলেকট্রন বিন্যাস।
নির্দেশনা (সংকেত/ ধাপ পরিধি):
- ক) পরমাণু মডেল বর্ণনা করা;
- খ) কোয়ান্টাম সংখ্যাসমূহ বর্ণনা করা;
- গ) কোয়ান্টাম সংখ্যা থেকে পরমাণুর বিভিন্ন শক্তিস্তরের ইলেকট্রন ধারণ ক্ষমতা নির্ণয় করা;
- ঘ) পরমাণুর উপশক্তিস্তরে – ইলেকট্রন বিন্যাসের নীতি ব্যাখ্যা করা;
HSC 2021 Chemistry 1st Assignment Answer
রাসায়নিক মৌলের ক্ষুদ্রতম অংশ যার স্বাধীন অস্তিত্ব নেই (নিস্ক্রিয় গ্যাসের পরমাণু ব্যতীত), কিন্তু রাসায়নিক বিক্রিয়ায় সরাসরি অংশ গ্রহণ করতে পারে সেসব আণুবীক্ষণিক কণিকাদিকে পরমাণু বলে । সমস্ত কঠিন, তরল, গ্যাস এবং আয়ন -এর গঠনের মূলে রয়েছে নিস্তরিত বা আধানগ্রস্ত পরমাণু । পরমাণুর আকার খুবই ক্ষুদ্র; সাধারনত এরা দৈর্ঘ্যে ১০০ পিকোমিটার ( ১ মিটারের ১০,০০০,০০০,০০০ ভাগ বা চুলের ১ লক্ষ ভাগের ১ ভাগ)।
পরমাণুর মডেল ও ইলেকট্রন বিন্যাস, কোয়ান্টাম সংখ্যা;
পরমানুর গঠন কেমন হতে পারে , তা নিয়ে বিজ্ঞানীরা অনেক গবেষণা করেছেন । এর মধ্যে অন্যতম হলো ডাল্টনের পরমাণুবাদ । আধুনিক রসায়ন এর ভিত্তি বলে পরিচিত ডাল্টনের পরমাণুবাদে পরমাণুকে অবিভাজ্য ধরা হয়েছে। কিন্তু এ তত্ত্ব এখন অচল। ঊনবিংশ শতাব্দীর শেষ ভাগে প্রমাণিত হয় যে, পরমাণুর তিনটি উপাদান। যেসব সূক্ষ কণিকা দিয়ে পরমাণু গঠিত, তাদেরকে মৌলিক কণিকা বলে । এরা হচ্ছে ইলেকট্রন , প্রোটন এবং নিউট্রন । এ তিনটি কণিকা বিভিন্ন সংখ্যায় একত্রিত হয়ে ভিন্ন ভিন্ন পরমাণু গঠন করে । ধনাত্মক আধানযুক্ত প্রোটন এবং আধানহীন নিউট্রন একত্রিত হয়ে নিউক্লিয়াস গঠন করে আর এদেরকে ঘিরে ঋণাত্মক আধানের ইলেকট্রন ঘুরছে ।
পরমাণু মডেল বর্ণনাঃ
১৯১১ খ্রিষ্টাব্দে বিজ্ঞানী রাদারফোর্ড সৌরমন্ডলের সাথে সাদৃশ্য রেখে পরমাণুর গঠন সম্পর্কে নিজস্ব মতবাদ উপস্থাপন করেন। এ মতবাদটিকে রাদারফোর্ডের সোলার সিস্টেম এটম মডেল বলা হয়ে থাকে। রাদারফোর্ডের পরমাণু মডেলের ত্রুটির দিকে লক্ষ্য রেখে নীলস বোর ১৯১৩ সালে ম্যাক্স প্ল্যাঙ্কের কোয়ান্টাম তত্ত্বের উপর ভিত্তি করে একটি পরমাণু মডেল উপস্থাপন করেন; যা বোর পরমাণু মডেল নামে পরিচিত। বোর পরমাণু মডেলের ৩ টি স্বীকার্য রয়েছে-
- ১. স্থির কক্ষপথের ধারণাঃ পরমাণুতে নিউক্লিয়াসের চারপাশে কতগুলো অনুমোদিত স্থির কক্ষপথ রয়েছে। ইলেকট্রনসমূহ এই স্থির কক্ষপথেই নিউক্লিয়াসের চারদিকে পরিভ্রমণ করে। প্রতিটি কক্ষপথ গুলো নির্দিষ্ট শক্তির হয়ে থাকে। ইলেকট্রন যতক্ষণ একটি স্থির কক্ষপথে অবস্থান করে, ততক্ষণ পর্যন্ত কোন শক্তি শোষণ বা বিকিরণ করবে না। এ কক্ষপথ গুলোকে শক্তিস্তর বা স্থির কক্ষপথ বা অরবিট বলে। শক্তিস্তরগুলোকে ‘n’ দ্বারা প্রকাশ করা হয়। n= 1 হলে প্রথম শক্তিস্তর, n = 2 হলে দ্বিতীয় শক্তিস্তর, n = 3 হলে তৃতীয় শক্তিস্তর ইত্যাদি হবে।
- ২. কৌণিক ভরবেগের ধারণাঃ প্রতিটি নির্দিষ্ট শক্তির স্থির কক্ষপথে আবর্তনরত ইলেকট্রন গুলির কৌণিক ভরবেগ h / 2π এর অখন্ড গুণিতক। অর্থাৎ এখানে n = 1, 2, 3…… ইত্যাদি পূর্ণ সংখ্যা হবে, কিন্তু কোন ভগ্নাংশ হবে না। n = প্রধান শক্তিস্তর, h=প্লাংক ধ্রুবক; এর মান 6.626×10-34 Js , m = ইলেকট্রনের ভর, v = ইলেকট্রনের রৈখিক বেগ, r = বৃত্তাকার কক্ষপথের ব্যাসার্ধ।
- ৩. বর্ণালির ধারণাঃ পরমাণুতে একটি ইলেকট্রন এক শক্তিস্তর হতে অন্য শক্তিস্তরে যদি স্থানান্তরিত হয় তবে শক্তির শোষণ বা বিকিরণ হয়। এখন পরমাণুকে যদি আমরা বাহির থেকে শক্তি সরবরাহ করি, তবে নিম্ন শক্তিস্তরের ইলেকট্রনগুলি শক্তি শোষণ করে উচ্চ শক্তিস্তরে স্থানান্তরিত হয়। অর্থাৎ শক্তির শোষণ ঘটে। আবার, পরমাণুতে শক্তির সরবরাহ বন্ধ করলে ইলেকট্রন যে শক্তি শোষণ করে উচ্চ শক্তিস্তরে স্থানান্তরিত হয়েছিল, ঠিক ঐ একই পরিমাণ শক্তি বিকিরণ করে নিম্ন শক্তিস্তরে স্থানান্তরিত হয়। অর্থাৎ এক্ষেত্রে শক্তির বিকিরণ ঘটে এবং বর্ণালীর সৃষ্টি হয়। এই বিকিরিত বর্ণালীর শক্তি E = hv যা তড়িৎ চুম্বকীয় বর্ণালী হিসাবে নির্গত হয়।
বোর পরমাণু মডেলের সীমাবদ্ধতাঃ
- ১. বোরের পরমাণু মডেল এক ইলেকট্রন বিশিষ্ট হাইড্রোজেন (H) বা আয়নসমূহ ( He+ , Li²+, Be³+ ইত্যাদি ) ক্ষেত্রে বর্ণালীর ব্যাখ্যা করা গেলেও একাধিক ইলেকট্রন বিশিষ্ট পরমানুর বর্ণালীর ব্যাখ্যা করতে পারে না।
- ২. ভারী পরমাণুর ক্ষেত্রে নিউক্লিয়াসের চারদিকে ঘুর্ণয়মান ইলেকট্রনগুলোর কক্ষপথ উপবৃত্তাকার হওয়া স্বাভাবিক। কিন্তু বোরের পরমাণু মডেলে এই কক্ষপথ গুলোকে বৃত্তাকার ধরা হয়েছে।
- ৩. উচ্চ শক্তিস্তর থেকে নিম্ন শক্তিস্তরে ইলেকট্রন ধাপান্তরের সময় বোর পরমাণু মডেল অনুসারে বর্ণালীতে একটি রেখা সৃষ্টি হওয়ার কথা। কিন্তু উচ্চক্ষমতাসম্পন্ন বর্ণালী মাপক যন্ত্রের সাহায্যে বিশ্লেষণ করলে দেখা যায়, একটি বর্ণালী রেখার পরিবর্তে একাধিক সূক্ষ্ম বর্ণালী রেখা পাওয়া যায়। বোর মডেল এই সূক্ষ্ম বর্ণালী রেখার উৎপত্তির কারণ ব্যাখ্যা করতে পারেনি।
পরমাণুর মডেল ও ইলেকট্রন বিন্যাস, কোয়ান্টাম সংখ্যা;
- ৪. পরমাণুতে চুম্বক ক্ষেত্রের প্রভাবে বর্ণালী রেখাগুলো একাধিক সূক্ষ্ম রেখায় বিভক্ত হয়ে পড়ে একে জীম্যান প্রভাব বলে। আবার, পরমাণুতে তড়িৎক্ষেত্রের প্রভাবে বর্ণালী রেখাগুলো একাধিক সূক্ষ্ম রেখায় বিভক্ত হয়ে পড়ে একে স্টার্ক প্রভাব বলে। এ মডেল জীম্যান প্রভাব ও স্টার্ক প্রভাব ব্যাখ্যা করতে পারে না।
- ৫. বোরের পরমাণু মডেল হাইজেনবার্গের অনিশ্চয়তা নীতির পরিপন্থী। হাইজেনবার্গের নীতি অনুসারে পরমাণুতে একটি ইলেকট্রনের অবস্থান ও ভরবেগ একই সঙ্গে নির্ণয় করা যায় না। এখানে ইলেকট্রনের কণা ও তরঙ্গ ধর্ম উভয় বিবেচনা করা হয়। কিন্তু বোর ইলেকট্রনকে শুধু কণা রূপে গণ্য করায়, তার মতে একই সময়ে ইলেকট্রনের অবস্থান ও ভরবেগ নির্ণয় করা সম্ভব।
- ৬. পরমাণুর প্রকৃত কাঠামো ত্রিমাত্রিক। কিন্তু বোরের মতবাদ অনুসারে পরমাণুর কাঠামো হলো দ্বিমাত্রিক।
- ৭. বোর পরমাণু মডেল থেকে বর্ণালী রেখার তীব্রতা ব্যাখ্যা করা যায় না।
- ৮. বোর মডেলে ইলেকট্রনের কৌণিক ভরবেগ mvr= nh / 2π এই মানের সঠিক কারণ ব্যাখ্যা করা হয়নি।
বোর তত্ত্বের সাফল্যঃ
- ১. বোর তত্ত্ব অনুসারে ইলেকট্রন যখন কোন একটা নির্দিষ্ট স্থির শক্তিস্তরে অবস্থান করে তখন ইলেকট্রনটি কোন শক্তি শোষণ বা বিকিরণ করে না। যার জন্য ইলেকট্রনটি পরমাণুর নিউক্লিয়াসে পতিত হওয়ার সম্ভাবনা থাকে না। অর্থাৎ এ তত্ত্ব অনুসারে পরমাণুর স্থায়িত্ব ব্যাখ্যা করা যায়।
- ২. বোর তত্ত্বের সাহায্যে পরমাণুতে বর্ণালীর ব্যাখ্যা করা সম্ভব হয়।
- ৩. বোর পরমাণু মডেলের সাহায্যে পরমাণুতে বিভিন্ন স্থির কক্ষপথের ব্যাসার্ধ ও কক্ষপথের শক্তি নির্ণয় করা যায়।
- ৪. বোর পরমাণু মডেল থেকে প্রধান কোয়ান্টাম সংখ্যার ধারণা পাওয়া যায়।
- ৫. বোর তত্ত্ব হতে ইলেকট্রন একটি শক্তিস্তর থেকে অন্য শক্তিস্তরে স্থানান্তরিত হলে কি পরিমান শক্তি শোষণ বা বিকিরণ করবে তা গণনা করা সম্ভব হয়েছে। অর্থাৎ বিভিন্ন শক্তিস্তরে আবর্তনশীল ইলেকট্রনের শক্তির পরিমাণ গণনা করা সম্ভব।
- ৬. বোর তত্ত্ব থেকে নির্ণীত রিডবার্গ ধ্রুবকের মান 109679 cm-1 এবং পরীক্ষালব্ধভাবে নির্ণীত রিডবার্গ ধ্রুবকের মান 109678cm-1 যা সমান।
রাদারফোর্ডের পরমাণুবাদ
১৯০৯ সালে বিজ্ঞানী আর্নেস্ট রাদারফোর্ড আলফা কণিকা বিক্ষেপণ পরীক্ষা সম্পাদন করেন। পরীক্ষালব্দ্ধ ফলাফল থেকে ১৯১১ সালে তিনি এই সিদ্ধান্তে উপনীত হন যে,
- পরমাণুর একটি কেন্দ্র আছে। এই কেন্দ্রের নাম নিউক্লিয়াস। নিউক্লিয়াসের ভেতরে প্রোটন এবং নিউক্লিয়াসের বাইরে ইলেকট্রন অবস্থান করে। যেহেতু আপেক্ষিকভাবে ইলেকট্রনের ভর শূন্য ধরা হয় কাজেই নিউক্লিয়াসের ভেতরে অবস্থিত প্রোটন এবং নিউট্রনের ভরই পরমাণুর ভর হিসেবে বিবেচনা করা হয়।
- নিউক্লিয়াস অত্যন্ত ক্ষুদ্র এবং পরমানুর ভেতরে বেশির ভাগ জায়গাই ফাঁকা।
- সৌরজগতে সূর্যকে কেন্দ্র করে বিভিন্ন কক্ষপথে যেমন গ্রহগুলো ঘুরে তেমনি নিউক্লিয়াসকে কেন্দ্র করে বিভিন্ন কক্ষপথে ইলেকট্রনগুলো ঘুরছে। কোনো পরমানুর নিউক্লিয়াসে যে কয়টি প্রোটন থাকে নিউক্লিয়াসের বাইরে সেই কয়টি ইলেকট্রন থাকে। যেহেতু প্রোটন এবং ইলেকট্রনের আধান একে অপরের সমান ও বিপরীত চিহ্নের তাই পরমানুর সামগ্রিকভাবেই আধান শূন্য।
- ধনাত্মক চার্জবাহী নিউক্লিয়াসের প্রতি ঋণাত্মক চার্জবাহী ইলেকট্রন এক ধরনের আকর্ষণ বল অনুভব করে। এই আকর্ষণ বল কেন্দ্রমুখী এবং এই কেন্দ্রমুখী বলের কারণে পৃথিবী যেরকম সূর্যের চারদিকে ঘুরে ইলেকট্রন সেরকম নিউক্লিয়াসের চারদিকে ঘুরে। রাদারফোর্ডের পরমানু মডেলকে সৌরজগতের সাথে তুলনা করা হয়েছে বলে এ মডেলটিকে সোলার সিস্টেম মডেল বা সৌর মডেল বলে। আবার, এ মডেলের মাধ্যমে বিজ্ঞানী রাদারফোর্ড সর্বপ্রথম নিউক্লিয়াস সম্পর্কে ধারণা দেন বলে এ মডেলটিকে নিউক্লিয়ার মডেল ও বলা হয়।
রাদারফোর্ডের পরমাণু মডেলের সীমাবদ্ধতাঃ
রাদারফোর্ড পরমাণুর যে মডেল তৈরি করেছিলেন পরবর্তীতে দেখা যায় সেই মডেল এর কিছু ত্রুটি ছিল। রাদারফোর্ডের পরমাণু মডেল এর ত্রুটি গুলি হলো-
১) রাদারফোর্ডের পরমাণু মডেল অনুসারে নিউক্লিয়াসকে ঘিরে নির্দিষ্ট কক্ষপথে আবর্তনশীল প্রত্যেক ইলেকট্রনের অভিকেন্দ্র ত্বরণ বর্তমান। তড়িৎগতিবিদ্যার তত্ত্ব অনুসারে , আহিত কণা ত্বরণ বা মন্দনসহ গতিশীল হলে ওই কণা তার মধ্যে নিহিত শক্তি নিরবচ্ছিন্নভাবে বিকিরণ করতে থাকে। সুতরাং, এই প্রক্রিয়ায় আবর্তনরত ইলেকট্রনের শক্তি অবিরাম হ্রাস পায় এবং তা নিউক্লিয়াসের আকর্ষণে ক্রমশ কাছে আসতে থাকে। ফলে , ইলেকট্রনটি ক্রমহ্রাসমান ব্যাসার্ধের কুণ্ডলী পথে আবর্তন করতে করতে একসময় নিউক্লিয়াসে গিয়ে আছড়ে পড়ে।
গণনায় দেখা যায় , এ ঘটনা 10-8 সেকেন্ড সময়ের মধ্যে ঘটা উচিত অর্থাৎ , রাদারফোর্ড পরমাণু মডেল 10-8 সেকেন্ড এই স্বল্প সময় ব্যবধানের জন্যই স্থায়ী হওয়ার কথা। বাস্তবে অবশ্য পরমাণুকে দীর্ঘসময় ধরে স্থায়ী অবস্থায় পাওয়া যায়। সুতরাং , রাদারফোর্ড মডেল পরমাণুর স্থায়িত্বের ব্যাখ্যা দিতে পারে না।
পরমাণুর মডেল ও ইলেকট্রন বিন্যাস, কোয়ান্টাম সংখ্যা;
২) শক্তি ক্ষয়ের ফলে বিভিন্ন কক্ষপথে ইলেকট্রনের ত্বরণের মান নিরবচ্ছিন্ন হারে পরিবর্তিত হওয়ায় বিকিরণ হিসেবে নিঃসৃত তরঙ্গের তরঙ্গদৈর্ঘ্যও নিরবচ্ছিন্নভাবে পরিবর্তিত হওয়া উচিত । সুতরাং, হাইড্রোজেন , হিলিয়াম ইত্যাদি মৌলের পারমাণবিক বর্ণালি প্রকৃতিগতভাবে নিরবচ্ছিন্ন বর্ণালি হওয়া উচিত। কিন্তু পরীক্ষালব্ধ ফলাফল দেখায় যে, এক্ষেত্রে ‘ রেখা বর্ণালি ’ সৃষ্টি হয় যার ব্যাখ্যা রাদারফোর্ড মডেল থেকে পাওয়া যায় না।
৩) এই মডেল পরমাণুর গঠন সম্পর্কে গুণগত ধারণা দিতে সক্ষম হলেও ইলেকট্রনের কক্ষপথের আকার ও ব্যাসার্ধ সম্বন্ধে কোনাে ধারণা দেয় না। আবর্তনরত ইলেকট্রনের বেগ ও গতিশক্তি সম্পর্কেও এই মডেল কোনাে আলােকপাত করে না।
কোয়ান্টাম সংখ্যাসমূহ বর্ণনাঃ
যে সকল রাশি বা সংখ্যা দ্বারা পরমাণুতে ইলেকট্রনের কক্ষপথ বা শক্তি স্তরের আকার ও আকৃতি, ত্রিমাত্রিক বিন্যাস এবং ইলেকট্রনের কক্ষপথের অক্ষ বরাবর স্পিন বা আবর্তন গতি সম্পর্কে তথ্য পাওয়া যায় তাকে কোয়ান্টাম সংখ্যা বলে।
কোয়ান্টাম সংখ্যা চার ধরনের। যথা-
১. প্রধান কোয়ান্টাম সংখ্যা(n)
যে কোয়ান্টাম সংখ্যার সাহায্যে পরমাণুতে অবস্থিত ইলেকট্রনের শক্তিস্তরের আকার নির্ণয় করা যায় তাকে প্রধান কোয়ান্টাম সংখ্যা বলে। একে n দ্বারা প্রকাশ করা হয়,n এর মান যথাক্রমে 1,2,3,4….. প্রভৃতি পূর্ণ সংখ্যা। প্রধান কোয়ান্টাম সংখ্যার মান বৃদ্ধি হলে নিউক্লিয়াস হতে প্রধান স্তরের দুরত্ব এবং শক্তিস্তরের আকার বৃদ্ধি পায়। বোর মতবাদ অনুসারে n=1 হলে ১ম শক্তিস্তর বা K শেল, n=2 হলে ২য় শক্তিস্তর বা L শেল, n=3 এবং n=4 হলে M ও N ইত্যাদি বোঝায়। যে কোনো প্রধান শক্তিস্তর সর্বোচ্চ 2n^2 ইলেকট্রন ধারণ করতে পারে।
২. সহকারী বা গৌন কোয়ান্টাম সংখ্যা(l)
যে কোয়ান্টাম সংখ্যার সাহায্যে শক্তিস্তরের আকৃতি নির্ণয় করা যায় তাকে সহকারী কোয়ান্টাম সংখ্যা বলে। সহকারী কোয়ান্টাম সংখ্যা, l এখন l এর মান 0 থেকে (n-1) পর্যন্ত হতে পারে। বোরের তত্ত্বে পরমাণু ছিল বর্তুলাকার। কিন্তু সোমারফিল্ড দেখান যে কক্ষপথ উপবৃত্তাকারও হতে পারে। তাছাড়া, হাইড্রোজেন পরমাণুর বর্ণালীর প্রতিটি রেখা আসলে ক্ষুদ্র ক্ষুদ্র অংশে বিভক্ত ছিলো। সোমারফিল্ড বললেন যে প্রতিটি অরবিট বা প্রধান শক্তিস্তর n সংখ্যক ভাগে বিভক্ত যাদের মধ্যে শক্তির সূক্ষ্ম পার্থক্য আছে। এর ফলেই সূক্ষ্ম রেখাগুলো দেখা যায়।
পরমাণুর মডেল ও ইলেকট্রন বিন্যাস, কোয়ান্টাম সংখ্যা;
৩. চৌম্বকীয় কোয়ান্টাম সংখ্যা (m)
যে সকল কোয়ান্টাম সংখ্যার সাহায্যে ইলেকট্রনের কক্ষপথের ত্রিমাত্রিক দিক বিন্যাস প্রকরণ সমূহ প্রকাশ করা হয়, তাকে ম্যাগনেটিক কোয়ান্টাম সংখ্যা বা চুম্বকীয় কোয়ান্টাম সংখ্যা বলে। চুম্বকীয় কোয়ান্টাম সংখ্যা, m এর মান -l থেকে l এর পর্যন্ত পূর্ণসংখ্যা। নন-ডিজেনারেট অবস্থায় অরবিটালসমূহ সমশক্তির, তবে চুম্বকক্ষেত্রে রাখলে শক্তির পার্থক্য তৈরি হয়। আর বলা বাহুল্য, z অক্ষ বরাবর অরবিটাল, যেমন p_z, d-z² এর বেলায় m=0
৪. ঘূর্ণন কোয়ান্টাম সংখ্যা (s)
নিজস্ব অক্ষের চারদিকে ইলেকট্রনের ঘুর্ণনের দিক প্রকাশক কোয়ান্টাম সংখ্যা সমূহকে স্পিন কোয়ান্টাম সংখ্যা বা ঘূর্ণন কোয়ান্টাম সংখ্যা বলে। এই কোয়ান্টাম সংখ্যা, s, ফার্মিয়ন কণার বেলায় তা ±½ এর গুণিতক। ইলেক্ট্রনের বেলায় তা ½.
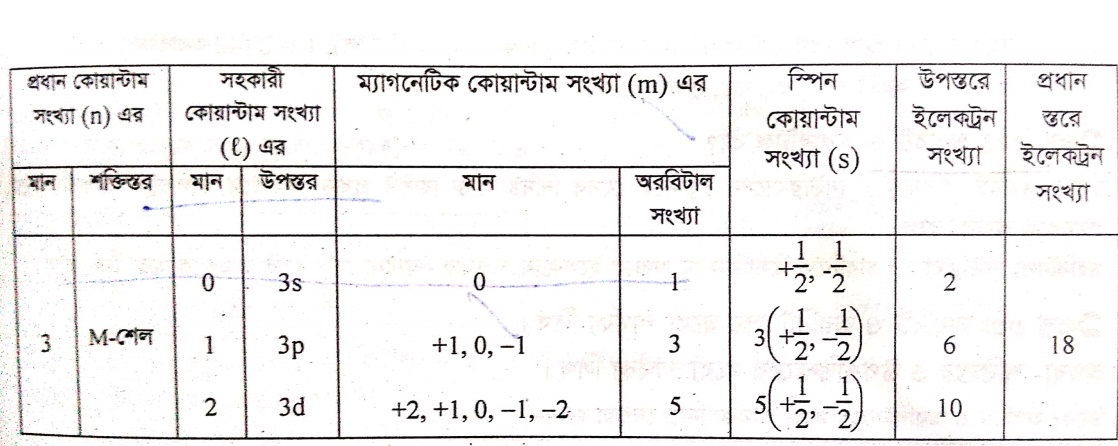
কোয়ান্টাম সংখ্যা থেকে পরমাণুর বিভিন্ন শক্তিস্তরের ইলেকট্রন ধারণ ক্ষমতা নির্ণয়ঃ
এখানে,
তৃতীয় শক্তি স্তরের জন্য, n=3
তাহলে । = 0,1,2 I=0 হলে,
l=0 হলে, m= 0; অতএব অরবিটাল 1টি
I=1,হলে, m= -1,0,+1; অতএব অরবিটাল 3টি
I=2 হলে, m= -2,-1,0,+1,+2; অতএব অরবিটাল 5টি
___________________________
মােট অরবিটাল 9টি
আমরা জানি, একটি অরবিটালের সর্বোচ্চ 2 টি ইলেকট্রন থাকতে পারে।
অতএব সর্বোচ্চ ইলেকট্রন সংখ্যা =9×2টি = 18টি (Ans.)
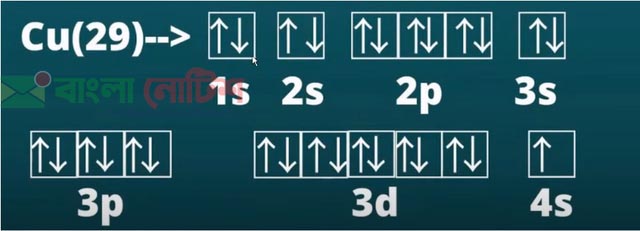
পরমাণুর উপশক্তিস্তরে – ইলেকট্রন বিন্যাসের নীতিঃ
আউফবাউ নীতিটি হলাে :
পরমাণুতে ইলেকট্রনসমূহ বিভিন্ন অরবিটালে তাদের শক্তির উচ্চক্রম অনুসারে | প্রবেশ করে। অর্থাৎ ইলেকট্রনসমূহ প্রথমে নিম্নশক্তির অরবিটাল পূর্ণ করে এর পরে ক্রমান্বয়ে উচ্চশক্তির অরবিটালে স্থান গ্রহণ করে পরমাণুর ইলেকট্রন বিন্যাস সম্পন্ন করে। এর কারণ হলাে নিম্ন শক্তিযুক্ত ইলেকট্রন বিন্যাস অধিক স্থিতিশীল । নিম্ন শক্তিস্তর থেকে ধারাবাহিকভাবে উচ্চশক্তিস্তরের অরবিটালে ইলেকট্রনসমূহের প্রবেশের এ নিয়মকে জার্মান, ভাষায়ু ‘উচ্চক্রম’ বােঝাতে আউফবাউ (aufbau) শব্দ ব্যবহৃত হয়েছে।
আউফবাউ নীতি (Aufbau principle) নামে তিনটি নিয়ম (rules) অনুসারে বিভিন্ন অরবিটালে ইলেকট্রন প্রবেশ করে। আউফবাউ’ হলাে জার্মান শব্দ; এর অর্থ ‘building up’। ইলেকট্রনগুলাে পরমাণুতে সম্ভাব্য নিম্নতম শক্তির। | ডিজেনারেট অরবিটালগুলােতে অবস্থান করলে এ অবস্থাকে গ্রাউন্ড স্টেট (ground state) ইলেকট্রন বিন্যাস বলে। সমশক্তির অরবিটালগুলােকে ডিজেনারেট (degenerate) অরবিটাল বলে। সমশক্তির ৩টি p-অরবিটাল, ৫টি d-অরবিটাল। ও ৭টি f-অরবিটাল আছে।
পাউলির বর্জন নীতিটি হলোঃ
১৯২৫ খ্রিষ্টাব্দে অস্ট্রিয়ার পদার্থ বিজ্ঞানী উলফ্গ্যাঙ্গ পাউলি (Wolfgang Pauli) এই বিধিটি উপস্থাপন করেন। এ বিজ্ঞানীর নামানুসারে এই বিধির নামকরণ করা হয়েছে পাউলি’র বর্জন নীতি ( pauli’s exclusion principle)। এই বিধিটি হলো―
“একই পরমাণুতে যে কোন দুইটি ইলেক্ট্রন চারটি কোয়ান্টাম সংখ্যার মান একই হতে পারে না”
এই সূত্র অনুসারে কোনো পরমাণুর ইলেক্ট্রনের অবস্থানগত বিন্যাস জানার জন্য চারটি কোয়ান্টাম সংখ্যা মান (কোয়ান্টাম সংখ্যা) জানা প্রয়োজন। এই বিধি অনুসারে যেসব মৌলিক কণিকার চক্রণের (spin) মান n+১/২ (যেখানে n একটি অঋণাত্মক পূর্ণসংখ্যা) অর্থাৎ যারা পদার্থের গাঠনিক উপাদান (এরা বলের কণিকাসমূহ, যাদের স্পিনের মান ০, ১, বা ২, তাদের থেকে ভিন্ন), তাদের যেকোন দুইটি কখনো একই কোয়ান্টাম দশায় থাকতে পারে না।
পাউলর বর্জনবিধি অনুসারে একই কক্ষে একই চক্রণমান যুক্ত ইলেক্ট্রন একই কক্ষে থাকতে পারে না। কিন্তু এই মান ভিন্ন হলে একটি কক্ষে ইলেক্ট্রন আবর্তিত হতে পারবে। যেমন― হিলিয়ামের পরমাণুর প্রথম কক্ষপথে দুটি ইলেক্ট্রন থাকে। এদের প্রথম তিনটি কোয়ান্টাম মান একই কিন্তু এদের চক্রণের দিক ভিন্ন, তাই একই কক্ষে দুটি ইলেক্ট্রন থাকতে পারে।
পাউলির এই মান পরমাণুর যেকোন মৌলিক কণার জন্য হতে পারে। এই চক্রণমানের উপর ভিত্তি করে, মৌলিক কণাগুলোকে প্রধানত দুটি ভাগে ভাগ করা হয়। ভাগ দুটো হলো―
- ১. যদি কণার পূর্ণ আবর্তন হয়, তবে তার আবর্তন মান হবে ১। তখন এই কণাগুলোকে বলা হবে বোসন।
- ২. যদি কণার অর্ধ-পূর্ণ আবর্তন হয়, তবে তার আবর্তন মান হবে ১/২। এই কণাগুলোকে বলা হয় ফার্মিয়ন।
হুন্ডের নিয়মটি হলাে :
একই শক্তিসম্পন্ন বিভিন্ন অরবিটালে ইলেকট্রনগুলাে এমনভাবে অবস্থান করবে যেন তারা সর্বাধিক সংখ্যায় অযুগ্ম বা বিজোড় অবস্থায় থাকতে পারে। এই সব অযু ইলেকট্রনের পিন একমুখী। হবে। একই শক্তিসম্পন্ন বিভিন্ন অরবিটাল’ বলতে তিনটি p অরবিটাল, পাঁচটি d অরবিটাল ও সাতটি f অরবিটালকে বােঝানাে হয় । s অরবিটালের জন্য হুন্ডের নিয়ম প্রযােজ্য নয়।
‘হুন্ডের নিয়ম’-এর দুটি অংশ রয়েছে। যেমন,
- সমশক্তির অরবিটালসমূহ (যেমন px, py, pz) এর – প্রতিটিতে প্রথমে একটি করে ইলেকট্রন প্রবেশ করে এবং শেষে অবশিষ্ট ইলেকট্রন দ্বারা যুগল কাঠন হতে পারে।
- অর্ধপূর্ণ অরবিটালসমূহে ইলেকট্রনসমূহ একইমুখী স্পিন বা parallet spin যুক্ত থাকে। কারণ একইমুখী স্পিনযুক্ত | ইলেকট্রনসমূহের মধ্যে বিকর্ষণ কম ঘটে; তাই অধিক স্থিতিশীল হয়।
ইলেকট্রন বিন্যাসের তিনটি নিয়ম (rule) এর সারাংশ হলাে নিম্নরূপ :
১। ইলেকট্রন সবচেয়ে নিম্নশক্তির অরবিটাল পূর্ণ করে শক্তির উচ্চক্রম অনুসারে পরের অরবিটালে প্রবেশ করে; শক্তিক্রম হলাে : 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d । এ নিয়মটিকে সাধারণত আউফবাউ নীতি বলা হয়।
২। একটি অরবিটালে দুটি বিপরীত স্পিনের ইলেকট্রন প্রবেশ করতে পারে। এটি হলাে পাউলির বর্জন নিয়মের মূল কথা (১৯২৫ খ্রি.)। বিভিন্ন মৌলের পারমাণবিক বর্ণালি বিশ্লেষণ পরীক্ষা করে পাউলি এ সিদ্ধান্তে পৌঁছেন।
৩। একই শক্তিসম্পন্ন বিভিন্ন অরবিটালে ইলেকট্রনগুলাে সম্ভাব্য অধিক সংখ্যায় বিজোড় অবস্থায় একই মুখী স্পিনযুক্ত থাকবে। এটিই হুন্ডের নিয়ম নামে পরিচিত। হুন্ডের নিয়মের মূলে রয়েছে ইলেকট্রন পরস্পরকে বিকর্ষণ করে এবং পরস্পর দূরে অবস্থান করে সম্ভাব্য নিম্নশক্তির স্থায়ী অবস্থায় থাকে।
এই ছিল তোমাদের জন্য প্রণীত এইচএসসি পরীক্ষা ২০২১ রসায়ন প্রথম পত্র ১ম অ্যাসাইনমেন্ট এর বাছাইকরা নমুনা উত্তর- পরমাণুর মডেল ও ইলেকট্রন বিন্যাস।
আরো দেখুন-
তোমাদের প্রতি সপ্তাহের অ্যাসাইনমেন্ট সংক্রান্ত আপডেট সবার আগে পাওয়ার জন্য বাংলা নোটিশ ডট কম এর এন্ড্রয়েড অ্যাপটি ডাউনলোড করে নাও। এখানে এ্যাসাইনমেন্ট সমাধান করা সংক্রান্ত যাবতীয় তথ্য প্রকাশিত হওয়ার সাথে সাথে পেয়ে যাবে।
এছাড়াও তোমার মনে থাকা যেকোন প্রশ্ন এখানে করার সুযোগ রয়েছে; নিয়মিত আপডেট পাওয়ার জন্য অ্যাপটি ডাউনলোড করে নাও;







বোরের পরমাণু মডেলটির সীমাবদ্ধতা সহ ব্যাখ্যা