ইলেকট্রন বিন্যাসই পরমানুর কাঠামাে রক্ষা করে
৮ম শ্রেণির সুপ্রিয় শিক্ষার্থী বন্ধুরা, আশা করছি সবাই অনেক ভালো আছো। তোমাদের জন্য আজকের আর্টিকেলটিতে রয়েছে ৮ম শ্রেণি দ্বাদশ সপ্তাহের এ্যাসাইনমেন্ট বিজ্ঞান এর বাছাইকরা নমুনা উত্তর- ছকের মৌলগুলাের ইলেক্ট্রনবিন্যাসের মডেল তৈরি কর; ইলেকট্রন বিন্যাসই পরমানুর কাঠামাে রক্ষা করে উপরােক্ত মৌলগুলাের আলােকে এর যৌক্তিকতা নিরূপণ কর;
৮ম শ্রেণি ২০২১ দ্বাদশ সপ্তাহ অ্যাসাইনমেন্ট বিজ্ঞান

অ্যাসাইনমেন্ট বা নির্ধারিত কাজ:
উপরের ছকের মৌলগুলাের ইলেক্ট্রনবিন্যাসের মডেল তৈরি কর; ইলেকট্রন বিন্যাসই পরমানুর কাঠামাে রক্ষা করে উপরােক্ত মৌলগুলাের আলােকে এর যৌক্তিকতা নিরূপণ কর;
সংকেত:
- ক) মডেল তৈরির জন্য সােলা, কাঠি, রঙ, তার, আঠা ইত্যাদি ব্যবহার
- খ) কাগজে অংকনের ক্ষেত্রে বিভিন্ন রঙ ব্যবহার করে চিত্রের উপাদান গুলােকে উপস্থাপন;
নির্দেশনা:
এই অ্যাসাইনমেন্ট সম্পন্ন করতে পাঠ্যপুস্তকের এই অধ্যায়ের ৯-১৩ পাঠ সম্পন্ন করতে হবে। সহজলভ্য উপকরণ নির্বাচন করে মডেল তৈরি করতে হবে কাজের ক্ষেত্রে যন্ত্রপাতি ব্যবহারে সাবধানতা অবলম্বন করতে হবে। মডেল খাতার সাথে প্রতিষ্ঠানে জমা দিতে হবে।
৮ম শ্রেণি দ্বাদশ সপ্তাহের এ্যাসাইনমেন্ট বিজ্ঞান এর বাছাইকরা নমুনা উত্তর
আণবিক পদার্থ বিজ্ঞান এবং কোয়ান্টাম রসায়ন অনুযায়ী ইলেক্ট্রন বিন্যাস হচ্ছে কোন অণু, পরমাণু বা অন্য কোন বস্তুতে ইলেক্ট্রনের সজ্জা। ইলেক্ট্রন নির্দিষ্ট সম্ভাব্য এলাকা জুড়ে পরিভ্রমণ করে যা অর্বিটাল নামে পরিচিত। এই অর্বিটালগুলোর আকৃতি এবং ইলেক্ট্রন ধারণক্ষমতা নিউক্লিয়াস থেকে অর্বিটালের দূরত্বের উপর নির্ভর করে বিভিন্ন হয়। প্রতিটি অর্বিটালের সর্বোচ্চ ইলেক্ট্রন ধারণক্ষমতা নির্দিষ্ট। অণু বা পরমাণুর কোন অর্বিটালে কতটি করে ইলেক্ট্রন অবস্থান করবে তা আউফবাউ নীতি অনুযায়ী নির্ধারিত হয়। কোন অণু বা পরমাণুর অর্বিটালগুলোতে কতটি করে ইলেক্ট্রন রয়েছে তা বিশেষ উপায়ে প্রকাশিত রূপই হচ্ছে ইলেক্ট্রন বিন্যাস।
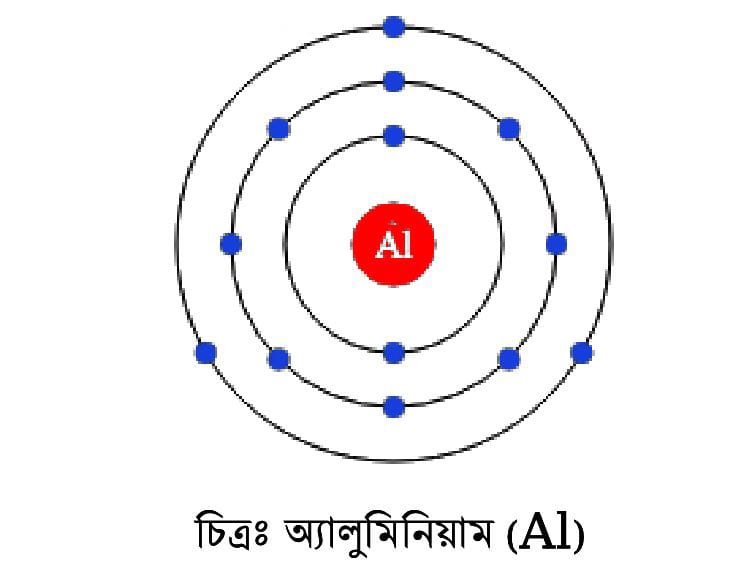
মৌলের নাম X, প্রােটন সংখ্যা ১৩। ছকে X চিহ্নিত মৌলটি হলাে অ্যালুমিনিয়াম (Al)। যার প্রােটন সংখ্যা ১৩। Al এর ইলেক্ট্রন বিন্যাস হলাে ২,৮,৩। নিম্নে মডেল দেওয়া হলােঃ
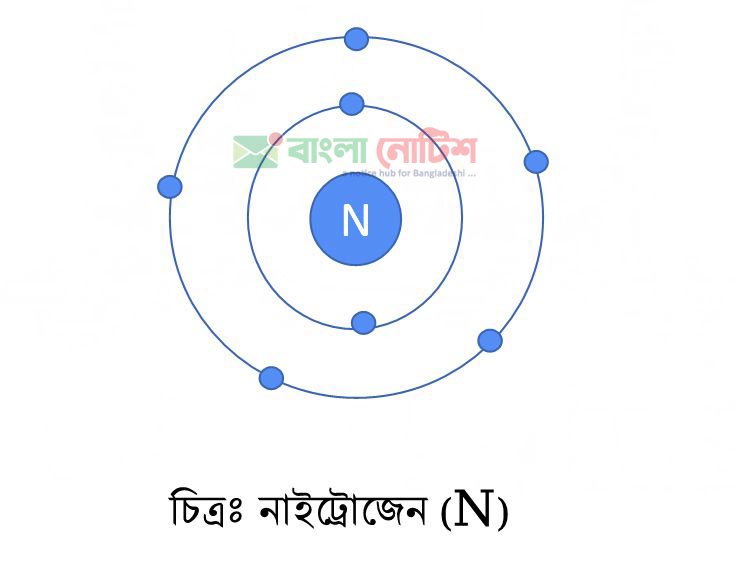
পরমাণুর নাম Y, প্রােটন সংখ্যা ৭। ছকে Y চিহ্নিত মৌলটি হলাে নাইট্রোজেন (N)। যার প্রােটন সংখ্যা ৭। N এর ইলেক্ট্রন বিন্যাস হলাে ২,৫। নিম্নে মডেল দেওয়া হলােঃ
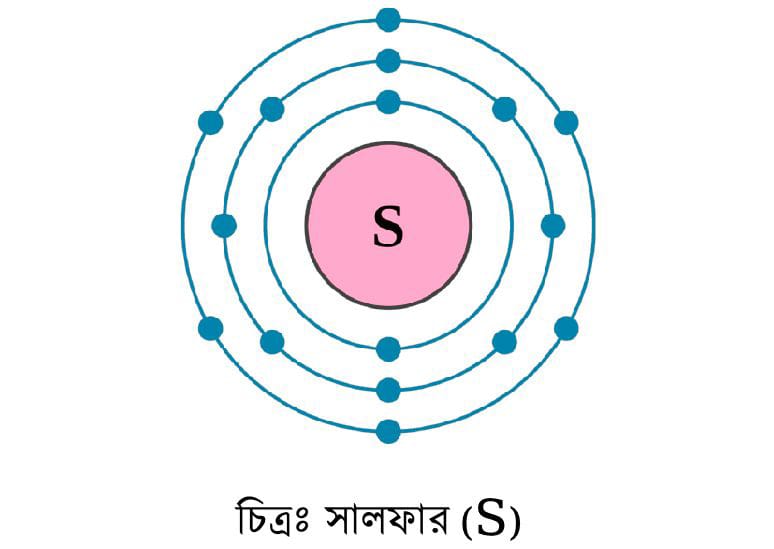
মৌলের নাম Z, প্রােটন সংখ্যা ১৬ ছকে Z চিহ্নিত মৌলটি হলাে সালফার (S)। যার প্রােটন সংখ্যা ১৬। S এর ইলেক্ট্রন বিন্যাস হলাে ২,৮,৬। নিম্নে মডেল দেওয়া হলােঃ
ইলেকট্রন বিন্যাসই পরমানুর কাঠামাে রক্ষা করে- যৌক্তিকতা নিরূপণঃ
ইলেকট্রন বিন্যাস হতে পরমাণুতে ইলেকট্রনগুলাে কিভাবে বিন্যস্ত থাকে সে সম্পর্কে ধারণা পাওয়া যায়। ইলেকট্রন পরমাণুর নিউক্লিয়াসের চারদিকে যতগুলাে কক্ষপথে ঘূর্ণায়মান থাকে, সে কক্ষপথগুলােকে বলা হয় স্থির কক্ষপথ বা শক্তিস্তর। ছকে X মৌলটি অর্থাৎ অ্যালুমিনিয়াম (Al) এর প্রােটন সংখ্যা ১৩।
এর ইলেক্ট্রন বিন্যাস ২,৮,৩। এটি ৩ টি কক্ষপথে অবস্থান করে। ১ম কক্ষপথে ২টি, ২য় কক্ষপথে ৮টি, ৩য় কক্ষপথে ৩টি। Y মৌলটি হলাে নাইট্রোজেন (N)। এর প্রােটন সংখ্যা ৭। এর ইলেক্ট্রন বিন্যাস ২,৫। এটি ২টি কক্ষপথে অবস্থান করে। ১ম কক্ষপথে ২টি, ২য় । কক্ষপথে ৫টি। এবং Z মৌলটি হলাে সালফার (S) এর প্রােটন সংখ্যা ১৬। এর ইলেক্ট্রন বিন্যাস ২,৮,৬। এটি ৩টি কক্ষপথে অবস্থান করে। ১ম কক্ষপথে ২টি, ২য় কক্ষপথে ৮টি, ৩য় কক্ষপথে ৬টি।
পরমাণুতে ইলেকট্রনের সংখ্যা যত বেশি হয় শক্তিস্তরের সংখ্যাও ততাে বেশি হয়। শক্তিস্তরের সংখ্যা যত বাড়ে পরমাণুর আকার তত বৃদ্ধি পায়। ফলে আমরা পরমাণুর ব্যাসার্ধ সম্পর্কে জানতে পারি। পরমাণুতে ইলেকট্রনগুলাে তার শক্তিস্তরে বিন্যস্ত হয়ে সর্বশেষ শক্তি স্তর সম্পর্কে ধারণা দেয়। তার থেকেই পরমাণুর আকার, আকৃতি সম্পর্কে ধারণা পাওয়া যায়। সুতরাং বলা যায় “ইলেকট্রন বিন্যাসই পরমাণুর কাঠামাে রক্ষা করে”।
বোনাস তথ্য 🙂
ইলেকট্রন বিন্যাসঃ কোন পরমাণুর ইলেকট্রন তার বিভিন্ন শক্তিস্তরে কিভাবে বিন্যস্ত থাকে তার প্রকাশকেই ইলেকট্রন বিন্যাস বলে।
ইলেকট্রন বিন্যাসের মূল বক্তব্য বোর পরমাণু মডেলের তত্ত্বের উপর প্রতিষ্ঠিত। ইলেকট্রন বিন্যাসের মূল বক্তব্য হলো-
- প্রতিটি পরমাণুতে একাধিক প্রধান শক্তিস্তর বিদ্যমান থাকবে। প্রত্যেক প্রধান শক্তিস্তর একটি সংখ্যা ‘n’ দ্বারা চিহ্নিত হয়। n এর মান সবসময় পূর্ণসংখ্যা হয়। যেমন, n=1,2,3……
- যে শক্তিস্তরটি নিউক্লিয়াসের খুব কাছাকাছি থাকে সেই শক্তিস্তরটি সবচেয়ে কম শক্তি সম্পন্ন হয়। অর্থাৎ, নিউক্লিয়াস থেকে শক্তিস্তরের দূরত্ব যত বাড়ে শক্তিস্তর ততো বেশি শক্তি সম্পন্ন হয়। ইলেকট্রন সাধারণত কম শক্তিসম্পন্ন স্তরে আগে প্রবেশ করে।
- অর্বিটালের আকৃতি এবং ইলেক্ট্রন ধারণক্ষমতাকে যথাক্রমে ইংরেজি বর্ণ s, p, d, f দ্বারা নির্দেশ করা হয়। এছাড়াও g, h এবং i বর্ণ দিয়েও নির্দেশ করার বিধান রয়েছে তবে এখনও পর্যন্ত এগুলো ব্যবহারের প্রয়োজন পড়েনি। প্রতিটি অর্বিটালের শক্তিমাত্রা নির্দিষ্ট। ইলেক্ট্রন এক শক্তিমাত্রার অর্বিটাল থেকে অন্য শক্তিমাত্রার অর্বিটালে চলে যেতে পারে। তবে এক্ষেত্রে প্রচুর পরিমাণ শক্তি গ্রহণ বা বর্জন করতে হয়।
এই ছিল তোমাদের ৮ম শ্রেণি দ্বাদশ সপ্তাহের এ্যাসাইনমেন্ট বিজ্ঞান এর বাছাইকরা নমুনা উত্তর- ছকের মৌলগুলাের ইলেক্ট্রনবিন্যাসের মডেল তৈরি কর; ইলেকট্রন বিন্যাসই পরমানুর কাঠামাে রক্ষা করে উপরােক্ত মৌলগুলাের আলােকে এর যৌক্তিকতা নিরূপণ কর;
আরো দেখুন-
প্রতি সপ্তাহে সকল স্তরের অ্যাসাইনমেন্ট সংক্রান্ত সকল তথ্য পাওয়ার জন্য বাংলা নোটিশ এর ফেসবুক পেজটি লাইক এবং ফলো করে রাখুন ইউটিউব চ্যানেল সাবস্ক্রাইব করে রাখুন এবং প্লেস্টোর থেকে অ্যান্ড্রয়েড অ্যাপটি ডাউনলোড করে রাখুন।